

Article paru dans le magasine Semper, édition Décembre 2020 – www.dsb.lu
Rubrique sous la responsabilité du Dr Manon Gantenbein, PhD, Responsable du Clinical and Epidemiological Investigation Center du LIH

Le Luxembourg Institute of Health (LIH) établit une collection de modèles précliniques de tumeurs cérébrales dérivées de patients pour accélérer le développement de nouveaux médicaments.
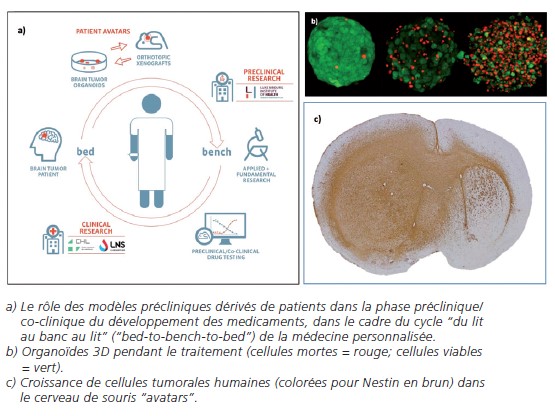
Le Laboratoire de Neuro-Oncologie ‘NORLUX’ du ‘Department of Oncology’ (DONC) du LIH, en collaboration avec le Centre Hospitalier de Luxembourg (CHL), le Laboratoire National de Santé (LNS), le Luxembourg Centre for Systems Biomedicine (LCSB) de l’Université de Luxembourg et d’autres partenaires internationaux, a établi une vaste collection de modèles organoïdes et de xénogreffes de gliomes dérivés de patients qui reproduisent les caractéristiques spécifiques des tumeurs cérébrales humaines. Ces outils permettront la mise en place d’études personnalisées permettant d’évaluer l’efficacité des médicaments, augmentant ainsi les chances de succès des essais cliniques et améliorant les résultats cliniques pour les patients. Les résultats ont été présentés dans une publication récente dans la revue internationale ‘Acta Neuropathologica’.
Les gliomes diffus adultes constituent un groupe particulièrement hétérogène de tumeurs cérébrales primaires, le glioblastome de grade IV (GBM) étant le sous-type le plus agressif. Malgré la chirurgie, la radiothérapie et la chimiothérapie, la survie médiane des patients atteints de GBM est de 14 mois, la récidive étant inévitable. L’une des principales raisons du mauvais pronostic pour les patients est le niveau élevé d’altérations génétiques de ce type de cancer, entraînant une forte prolifération et une invasion généralisée par les cellules tumorales vers le parenchyme cérébral, ainsi qu’une forte résistance au traitement. De plus, les gliomes sont très hétérogènes et diffèrent selon les patients, ce qui suggère la nécessité d’approches de traitement plus personnalisées, où le traitement de chaque patient est conçu pour cibler les modifications génétiques spécifiques détectées dans la tumeur de l’individu. Par exemple, il a été démontré que le statut de méthylation de l’ADN du promoteur du gène MGMT (O-6-méthylguanine-ADN mé¬thyltransférase) dans les GBM affecte la réponse au témozolomide (TMZ), l’agent chimiothérapeutique standard. En effet, l’enzyme MGMT répare les lésions de l’ADN induites par le TMZ, contrecarrant son activité et constituant ainsi l’un des mécanismes majeurs de résistance aux médicaments dans un sous-groupe de patients ateints de gliome. En outre, plusieurs études suggèrent que les gliomes diffus subissent des changements évolutifs lors du traitement et pendant la récidive, bien que l’on ne sache pas dans quelle mesure le traitement standard actuel conduit à des changements moléculaires qui pourraient affecter les réponses aux médicaments dans le cadre de la médecine de précision. Le développement de nouvelles stratégies de traitement efficaces est donc d’importance vitale.
Les essais cliniques sont cruciaux afin de tester l’efficacité et la sureté de nouvelles molécules thérapeutiques directement sur les patients. Cepen¬dant, tous les essais cliniques récents chez les patients atteints de gliome ont échoué. En effet, leur succès dépend fortement de la qualité des résultats obtenus lors des études précliniques menées sur des modèles expérimentaux de tumeur en amont de la phase clinique. Les lignées cellulaires de GBM et les modèles de souris génétiquement modifiés traditionnellement utilisés dans la recherche sur le GBM présentent plusieurs inconvénients et ne récapitulent pas avec précision certaines caractéristiques génétiques et histopathologiques des tumeurs des patients, fournissant ainsi des réponses et des résultats de traitement inadéquats. La disponibilité de modèles précis et crédibles qui reflètent la totalité des variations génétiques observées dans les cancers du cerveau et qui permettent de prédire de ma¬nière fiable la sensibilité des tumeurs à de nouveaux traitements personnalisés est donc cruciale dans le contexte de l’oncologie translationnelle et de la médecine personnalisée.
Pour répondre à ce besoin, NORLUX a travaillé en étroite collaboration avec le Centre Hospitalier de Luxembourg (CHL) et les principaux instituts de recherche luxembourgeois pour mettre en place une collection de tumeurs cérébrales de plus de 1000 patients. Grâce aux échantillons fournis par le service de neurochirurgie du CHL, NORLUX a généré une biobanque d’organoïdes de tumeurs cérébrales (des cultures tissulaires tridimensionnelles dérivées de cellules viables de tumeurs). Ces organoïdes tumoraux sont ensuite implantés chez des souris immunodéficientes pour créer ce que l’on appelle des xénogreffes orthotopiques dérivées du patient (Patient-Derived Orthotopic Xenografts, PDOX). NORLUX a actuellement établi une cohorte complète de plus de 40 PDOX provenant de gliomes malins, y compris le glioblastome.
Ces modèles agissent comme des «avatars» de patients et ont une pertinence clinique importante, car ils reproduisent fidèlement les principales caractéristiques biologiques, histologiques et génomiques des tumeurs d’origine.
La cohorte comprend des PDOX de gliomes primaires et récurrents, à différents stades, de différents sous-types et avec différentes mutations génétiques. Des PDOX uniques dérivés d’échantillons de tumeurs du même patient avant et après le traitement sont également disponibles, améliorant ainsi la compréhension de la façon dont les cancers répondent aux différents traitements en fonction de leurs caractéristiques génétiques.
Les organoïdes des cancers du cerveau et les avatars qui en résultent ont une valeur unique en tant que plate-forme pour tester l’efficacité des médicaments dans les études précliniques et co-cliniques. Concrètement, ils peuvent être mis à profit dans le cadre de l’oncologie de précision, comme dans l’essai clinique en cours pour le profilage fonctionnel personnalisé (PFP), mené par LIH en collaboration avec le CHL, les Hôpitaux Robert Schuman (HRS), l’IBBL et le LNS, tout comme dans les études de recherche en partenariat avec des sociétés pharmaceutiques.
En effet, dans leur étude, les chercheurs du LIH ont testé sur leurs organoïdes et PDOX l’efficacité de VAL-083 (dianhydrogalactitol), un composé de DelMar Pharmaceuticals. VAL-083 est une molécule qui introduit des lésions dans l’ADN, causant ainsi la mort des cellules cancéreuses. Surtout, VAL- 083 peut pénétrer la barrière hémato-encéphalique, s’accumulant dans le liquide céphalo-rachidien et dans le parenchyme cérébral. Il est actuellement en cours de test dans divers essais cliniques pour le GBM récurrent et pour le GBM sans méthylation du promoteur du MGMT. L’équipe de recherche du LIH a montré que VAL-083 était nettement plus efficace que le TMZ. Contrairement au TMZ, son action n’est pas affectée par le statut de méthylation du promoteur du MGMT, ce qui suggère que VAL-083 est capable de surmonter le phénomène de résistance au TMZ.
De plus, les scientifiques ont démontré que le composé entraînait une réduction considérable de la croissance et du volume de la tumeur, ainsi qu’une augmentation des lésions de l’ADN des cellules tumorales, tout en ne présentant aucune toxicité pour les cellules saines.
«Nos résultats indiquent le potentiel de VAL-083 en tant que candidat prometteur pour le traitement du glioblastome, et démontrent en outre que nos organoïdes de GBM dérivés de PDOX présentent des réponses aux médicaments cliniquement pertinentes, ce qui permet de les utiliser dans le développement de médicaments personnalisés», explique le Dr Anna Golebiewska, responsable de NORLUX et co-premier auteur de la publication scientifique.
«Notre travail est le résultat d’une approche interdisciplinaire basée sur les compétences complémentaires de l’écosystème de recherche biomédicale luxembourgeois», expliquent le Dr Ann-Christin Hau et Anaïs Oudin de l’équipe de recherche NORLUX et co-premiers auteurs de la publication.
«La mise en place d’une telle biobanque de modèles précliniques s’est appuyée sur le soutien précieux du Pr F. Hertel et de son équipe du service de neurochirurgie au CHL, qui nous ont permis de mener l’étude. Le LNS a contribué grâce à l’expertise reconnue de ses centres nationaux de pathologie et de génétique, le LCSB a réalisé le séquençage de cellules uniques, tandis que le Centre d’Investigation et d’Epidémiologie Clinique (CIEC) du LIH a organisé la collecte des échantillons de tissus, tout en assurant la confidentialité des données des patients. Plus important encore, nous tenons à exprimer notre gratitude à tous les patients et à leurs familles pour avoir rendu notre étude possible grâce à leur participation. Nous sommes convaincus que nos modèles précliniques accéléreront la translation des résultats de la recherche fondamentale afin d’améliorer les traitements cliniques pour les futurs patients», ajoutent-elles.
La collection de 40 modèles de gliomes et leurs données associées est mise à disposition de la communauté scientifique internationale sur PDXfinder, un catalogue mondial ouvert co-développé par le Laboratoire Européen de Biologie Moléculaire - Institut Européen de Bioinformatique (EMBL - EBI) et par le Jackson Laboratory.
«En partageant nos modèles et données et en collaborant avec des partenaires internationaux prestigieux dans le cadre d’initiatives telles que le consortium ‘EurOPDX’, financé par Horizon 2020, et le consortium ‘Glioma Longitudinal AnalySiS’ (GLASS), nous contribuons constamment à accroître la disponibilité et l’utilisation de ces ressources inestimables au niveau global, soutenant ainsi de manière tangible les percées dans la thérapie personnalisée du cancer», conclut le Pr Simone Niclou, directeur du Department of Oncology du LIH et auteur correspondant de la publication.
Les résultats ont été publiés en octobre 2020 dans la revue internationale ‘Acta Neuropathologica’, avec le titre complet «Patient-derived organoids and orthotopic xenografts of primary and recurrent gliomas represent relevant patient avatars for precision oncology».
Cette étude a été soutenue par des subventions du Télévie-FNRS, de la Fondation Cancer Luxembourg, du Fonds National de la Recherche luxembourgeois et de GLIOTRAIN ITN financé par l’UE H2020.
L’étude a été réalisée en étroite collaboration avec des partenaires nationaux et internationaux, et a impliqué le Department of Oncology du LIH, y compris le laboratoire de neuro-oncologie NORLUX, le service de neurochirurgie du Centre Hospitalier de Luxembourg, la Quantitative Biology Unit du LIH, le Laboratoire National de Santé, le Luxembourg Centre for Systems Biomedicine de l’Université du Luxembourg, l’Université de Heidelberg (Allemagne), l’Université de Bergen (Norvège), Henry Ford Health System (USA), la Technische Universität Dresden (Allemagne), le Leeds Institute of Medical Research at St James’s University Hospital (Royaume- Uni) et DelMar Pharmaceuticals (USA, Canada).
«Les essais cliniques sont cruciaux afin de tester l’efficacité et la sureté de nouvelles molécules thérapeutiques directement sur les patients.» |
for articles/videos/studies
The articles can be sorted by therapeutic area or disease, but may also deal with more general topics not specifically related to a disease. These articles can be sorted as "other".