

Une rubrique originale de Semper Luxembourg – www.dsb.lu - en collaboration avec la Division de la Pharmacie et des Médicaments - Sous la Direction du Dr Anna Chioti
Dans la foulée de la lettre circulaire adressée au Corps médical et aux Professionnels de la santé par la Direction de la Santé, ce dossier reprend l’essentiel de ce qu’il faut savoir sur la pharmacovigilance dans le contexte d’une vaccination de masse, en plus des dispositions déjà en place. Dans le cas particulier de la pandémie, l’Agence européenne des médicaments (EMA) et la Commission Européenne exigent en effet la mise en place de systèmes de collecte active des données de vaccination individuelles et ce afin d’évaluer en temps réel le bénéfice-risque des vaccins COVID-19.
Au Luxembourg, la collecte des données de vaccination se fait au moyen de la plateforme MSVAC1 mise à disposition des vaccinateurs. La Division de la Pharmacie et des Médicaments (DPM) de la Direction de la santé est en charge de suivre les signalements qui remontent via la plateforme MSVAC, mais aussi via les canaux habituels de la pharmacovigilance.
Que déclarer dans le cadre particulier de la pandémie
• Ce qui est spontanément rapporté par le patient (important de ne pas solliciter des effets !)
• Ce que vous jugez possiblement lié au vaccin (important de préciser le nom du vaccin !)
• Prioritairement les effets indésirables qui sont
- inattendus (non listés dans le RCP2) et/ou
- listés dans le RCP mais présentant un caractère sévère inattendu et/ou
- que vous considérez comme graves (voir définitions dans la section 1).
Cas particulier: effets indésirables immédiats survenant sur le site de vaccination3
Le registre national MSVAC est le système de collecte active des données de vaccination individuelles que la Direction de la santé a mis en place.
De plus, MSVAC permet au vaccinateur de déclarer les effets indésirables qui surviendraient immédiatement (dans les 15 minutes) sur le site de vaccination, ce afin de faciliter la déclaration de ces effets. Ce mode de déclaration est réservé exclusivement aux effets indésirables immédiats. Les effets indésirables retardés ne doivent être saisis dans cet outil. Le formulaire de notification mentionné plus haut doit être utilisé le cas échéant.
Il est important de rappeler que MSVAC n’est pas une base de pharmacovigilance et n’a pas vocation de collecter tout événement indésirable tel que ce serait le cas dans le cadre d’un essai clinique. Cela biaiserait toute l’analyse réalisée par les autorités nationales et l’Agence Européenne des médicaments en vue de détecter d’éventuels nouveaux signaux de sécurité.
1 MSVAC: registre des vaccinations contre le COVID-19 visant à collecter les informations essentielles relatives à la personne vaccinée
2 Les RCPs des vaccins disponibles sont consultables ici: https://covid19.public.lu/fr/vaccination/infovaxx.html
3 Une procédure détaillant les circuits de déclaration des effets indésirables et la saisie des données dans MSVAC est mise à disposition de tout vaccinateur utilisateur de MSVAC.
Comment déclarer les effets indésirables de manière généraleDe manière générale, les effets indésirables sont à déclarer via le circuit classique de notification des effets indésirables, à savoir: En s’aidant du formulaire de notification des effets indésirables disponible sur www.sante.lu ou MyGuichet.lu: https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html Au Centre Régional de Pharmacovigilance (CRPV) de Nancy et à la Division de la pharmacie et des médicaments (DPM), de préférence par email à crpv@chru-nancy.fr et pharmacovigilance@ms.etat.lu |
Pour la vaccination COVID-19, les mêmes règles de base sont d’application. Nous reprenons ici quatre diapositives de synthèse très claires présentées par Anne-Cécile Vuillemin, Pharmacien Inspecteur, toxicologue, en charge de la pharmacovigilance au sein de la Division de la Pharmacie et des Médicaments (DPM) de la Direction de la Santé, dans le cadre de formations en matière de pharmacovigilance.
.jpg)
Plus que jamais, la pharmacovigilance est l’affaire de tous !Dans le cadre de la vaccination COVID-19, des moyens techniques et humains extraordinaires ont été déployés afin de nous permettre de transmettre les cas à l’agence européenne dans des délais raccourcis, de documenter rapidement et de manière complète les effets afin d’en faire une évaluation précise écartant les coïncidences et, le cas échéant, de surveiller de manière rapprochée les personnes exposées. Ce travail ne peut pas se faire sans la participation de tous les acteurs concernés par la pharmacovigilance. |
Pharmacovigilance
Ensemble des techniques d’identification, d’évaluation et de prévention du risque d’effet indésirable des médicament/vaccin ayant une autorisation de mise sur le marché (AMM)
Résumé des caractéristiques du produit (RCP)
Résumé standard pour tout médicament/vaccin ayant une autorisation de mise sur le marché. Il correspond à l’information destinée aux professionnels de santé pour l’utilisation optimale d’un médicament/vaccin en termes de sécurité et d’efficacité. Ce résumé fait partie intégrante de l’AMM.
Effet indésirable
Réaction nocive et non voulue à un médicament/vaccin, se produisant aux posologies normalement utilisées chez l’homme pour la prophylaxie, le diagnostic ou le traitement d’une maladie ou la modification d’une fonction physiologique.
Effet indésirable attendu
Effet indésirable dont le type, la gravité ou la fréquence sont mentionnés dans le résumé des caractéristiques du produit. Peut généralement être expliqué par l’une des propriétés pharmacologiques du médicament/vaccin. Il s’agit donc d’un effet assez fréquent, généralement connu dès les essais cliniques, donc avant l’autorisation de mise sur le marché (AMM). Effet indésirable grave Effet indésirable entraînant le décès ou mettant le pronostic vital en jeu ou entraînant une invalidité ou une incapacité significative ou entraînant (prolongeant) une hospitalisation ou entraînant une anomalie ou malformation congénitale (dans la cas d’un médicament pris par la mère pendant ou avant la grossesse) ou médicalement significatif*. *médicalement significatif: considéré comme grave par un médecin, c’est à dire ayant des conséquences cliniques importantes mais ne correspondant pas à l’un des autres critères de gravité.
Effet indésirable inattendu
Effet indésirable dont la nature, la gravité ou la fréquence ne sont pas mentionnés dans la monographie du médicament ou résumé des caractéristiques du produit. Effet indésirable dont la survenue ne peut être expliquée par l’une des propriétés pharmacologiques du médicament. Il s’agit d’un effet rare, voire exceptionnel, qui n’a pratiquement aucune chance d’être détecté au cours des essais cliniques (et n’est donc pas pris en compte lors de l’AMM).
Fiche de recueil d’effet indésirable
Document rempli par le déclarant et comportant les données nécessaires à la constitution d’un dossier de notification.
Déclarant
La personne qui déclare un cas d’effet indésirable à une autorité de santé.
Notification
Transmission de l’effet indésirable d’un médicament/vaccin à un centre de pharmacovigilance. Elle doit comporter au minimum: un déclarant identifiable, un patient identifiable, un ou des médicaments/vaccins suspects, un ou des effets indésirables.
| Pour toute autre question au sujet des vaccinations ou de la pharmacovigilance, le Corps médical et les Professionnels de la santé peuvent contacter la Direction de la santé par e-mail: Direction-Sante@ms.etat.lu LUXDPM@ms.etat.lu |
.jpg)
Source: Presentation by Sabine Straus on behalf of EMA, as Chair of Pharmacovigilance Risk Assessment Committee (PRAC)
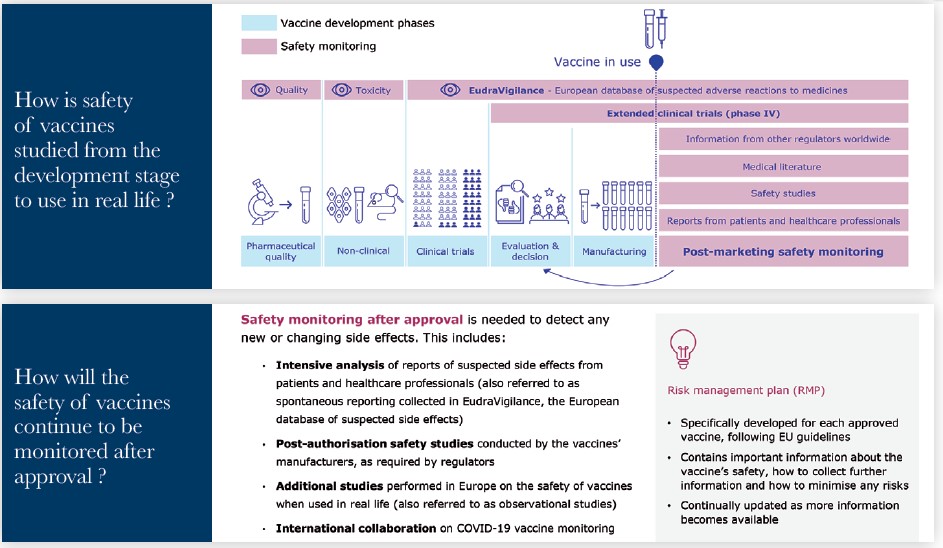
.jpg)

.jpg)
for articles/videos/studies
The articles can be sorted by therapeutic area or disease, but may also deal with more general topics not specifically related to a disease. These articles can be sorted as "other".