

Article paru dans le magazine Semper Luxembourg, en collaboration avec la Division de la Pharmacie et des Médicaments, Rubrique REGULATORY sous la Direction du Dr Anna Chioti – édition décembre 2021 – www.dsb.lu
Nous voici, à présent, dans la 4ème et dernière étape de cette visite guidée du RCP. La dernière section qu’il nous reste à parcourir, est consacrée aux propriétés pharmacologiques du médicament et est subdivisée en 3 sous-sections standard, tel qu’illustré dans l’architecture générale du RCP ci-dessous.

Les propriétés pharmacologiques des médicaments sont décrites à travers les données de pharma¬codynamie et de pharmacocinétique, auxquelles il faut ajouter les données de sécurité préclinique et qui pourraient être pertinentes pour le prescripteur. Pour rappel, la pharmacodynamie appliquée à la clinique est l’étude des effets d’un médicament sur l’organisme. Elle est complémentaire de la pharmacocinétique qui explore les effets de l’organisme sur les médicaments. Un effet peut être décrit par son intensité, son délai d’apparition et sa durée. La pharmacodynamie peut s’intéresser aux effets bénéfiques mais aussi aux effets indésirables ou toxiques.
Cette section fournit des informations claires et concises pertinentes aux professionnels de la santé concernant la ou les indications thérapeutiques approuvées, des données de sécurité clinique spécifiques ainsi que des données cliniques pertinentes dans des populations particulières (par exemple, les enfants ou les personnes âgées). Elle est régulièrement mise à jour lorsque de nouvelles informations sont disponibles, en particulier en ce qui concerne les informations pédiatriques.
Par ailleurs, les rapports publics d’évaluation (appelés «EPAR» pour European Public Assessment Report) fournissent des informations détaillées sur les médicaments et sont disponibles sur le site de l’Agence européenne des médicaments, qui publie des informations détaillées sur les médicaments évalués par le comité des médicaments à usage humain (CHMP).
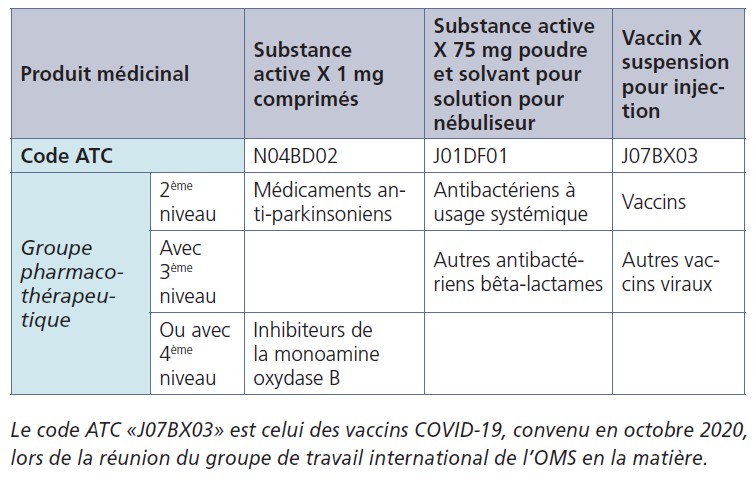
Le Système de classification anatomique, thérapeutique et chimique (en anglais: Anatomical Therapeutic Chemical (ATC) Classification System) est utilisé pour classer les médicaments. C’est le Collaborating Centre for Drug Statistics Methodology de l’Organisation mondiale de la santé (OMS) qui le contrôle. Dans le système de classification ATC de l’OMS (www.whocc.no), les médicaments sont divisés en différents groupes en fonction de l’organe et du système sur lesquels ils agissent et de leurs propriétés chimiques, pharmacologiques et thérapeutiques.
La section 5.1 va dès lors inclure le sous-groupe thérapeutique (2e niveau) avec le sous-groupe pharmacologique (3e niveau) ou bien avec le sous-groupe chimique (4e niveau), comme l’illustrent les exemples ci-dessous:
La description du mécanisme d’action avec, le cas échéant, les informations sur les effets pharmacologiques, pertinents pour les professionnels de la santé, ainsi que l’(les) indication(s) approuvée(s), l’(les) effet(s) indésirable(s) potentiel(s) se fera au moyen des seules conclusions d’études non cliniques susceptibles d’être intéressantes.
Par exemple, pour un «Principe actif X 25 mg/ml solution à diluer pour perfusion», on pourra lire:
Mécanisme d’action: «La substance active X se lie au facteur de croissance endothélial vasculaire (VEGF), le principal moteur de la vasculogenèse et de l’angiogenèse, et inhibe ainsi la liaison du VEGF à ses récepteurs, Flt- 1 (VEGFR-1) et KDR (VEGFR-2), à la surface des cellules endothéliales. La neutralisation de l’activité biologique du VEGF régresse la vascularisation des tumeurs, normalise la vascularisation tumorale restante et inhibe la formation de nouvelles vascularisations tumorales, inhibant ainsi la croissance tumorale.»
Effets pharmacodynamiques: «L’administration de la substance active X ou de son anticorps murin parental à des modèles de xénogreffe de cancer chez la souris nude a entraîné une activité antitumorale étendue dans les cancers humains, notamment du côlon, du sein, du pancréas et de la prostate. La progression de la maladie métastatique a été inhibée et la perméabilité microvasculaire a été réduite.»
Dans cette rubrique, le RCP fournit un résumé concis des résultats concernant les critères d’évaluation prédéfinis ou les résultats cliniques des principaux essais qui appuient les indications approuvées, y compris la description des principales caractéristiques de la population de patients étudiée. Les résultats de ces études doivent être statistiquement convaincants et cliniquement pertinents pour fournir le critère d’évaluation principal (obligatoire), le(s) critère(s) secondaire(s) (au cas par cas) et les analyses en sous-groupe ou post-hoc (exceptionnel).
Pour les vaccins COVID-19, cette section va résumer les données les plus pertinentes issues des études cliniques du dossier soumis par les fabricants à l’EMA et qui ont fait l’objet de l’évaluation en vue de leur approbation.
Les résultats de toutes les études pharmacodynamiques (cliniquement perti¬nentes) ou d’efficacité menées chez les enfants sont présentés par âge ou par sous-ensemble pertinent. Si les données sont considérées comme non concluantes, cela sera spécifiquement indiqué.
S’il n’y a pas d’indication autorisée dans la population pédiatrique ou le sous-ensemble pédiatrique, cela sera précisé avec un renvoi à la section 4.2 (Posologie et mode d’administration) et, le cas échéant, à la section 4.3 (Contre-indications).
Les informations sont mises à jour lorsque de nouvelles informations pertinentes sont disponibles. Par exemple, les résultats des études de confirmation vont remplacer ceux des études exploratoires.
Dans le cas des vaccins COVID-19, les RCP contiennent la mention suivante: «Une autorisation de mise sur le marché «conditionnelle» a été délivrée pour ce médicament. Cela signifie que des preuves supplémentaires concernant ce médicament sont attendues. L’Agence européenne des médicaments réévaluera toute nou¬velle information sur ce médicament au moins chaque année et, si néces¬saire, ce RCP sera mis à jour.»
Cette rubrique fournit les proprié¬tés pharmacocinétiques de la ou des substances actives pertinentes pour la dose recommandée, le dosage et la formulation pharmaceutique com¬mercialisée. Si ceux-ci ne sont pas disponibles, les résultats obtenus avec d’autres voies d’administration, d’autres formes pharmaceutiques ou posologies peuvent être renseignés comme alternative.
Des valeurs moyennes avec une mesure de la variabilité seront données pour les paramètres pharmacocinétiques primaires de base (par exemple, la biodisponibilité, la clairance et la demi-vie).
Les propriétés pharmacocinétiques (PK) d’ «ADME», c’est-à-dire d’Absorption, Distribution, Métabolisme, Élimination y sont présentées, après une introduction générale mentionnant, le cas échéant,
• Si le médicament est une pro-drogue.
• S’il y a des métabolites actifs.
• La chiralité, la solubilité.
• La population dans laquelle les données PK ont été obtenues, etc.
L’absorption correspond à l’ensemble des phénomènes intervenant dans le transfert du principe actif médicamenteux depuis son site d’administration jusqu’à la circulation sanguine. L’absorption d’un médicament est déterminée par ses propriétés physico-chimiques, sa formulation galénique et sa voie d’administration, d’où la mention des précisions suivantes dans le RCP:
• Absorption complète ou incomplète.
• Biodisponibilité absolue et/ou relative.
• Tmax.
• Influence de la nourriture.
• Effet de premier passage.
• Implication des protéines de transport.
• Biodisponibilité systémique en cas de médicament appliqué localement.
• Informations sur le site d’absorption dans le tractus gastro-intestinal si disponibles (peut être important pour l’administration par sonde d’alimentation entérale).
Le Tmax est le temps d’atteinte de la concentration maximale Cmax; en général, Tmax et Cmax sont en relation inverse. Un Tmax petit signifie une absorption rapide et complète entraînant une Cmax élevée.
Par exemple, pour des médicaments hypnotiques, on recherchera un Tmax court. Un Tmax grand peut aussi indiquer une résorption plus étalée du médicament dans le tube digestif et donc plus sujette aux effets de l’alimentation.
La distribution correspond au processus de répartition du médicament dans l’ensemble des tissus et organes. Les données en lien avec la distribution incluent:
• La liaison aux protéines plasmatiques (influence la durée d’action du médicament).
• Le volume de distribution (l/kg).
• Les concentrations tissulaires et/ou plasmatiques.
• L’implication des protéines de transport.
Le métabolisme correspond à la transformation enzymatique du médicament en un ou plusieurs composés, dits métabolites qui peuvent être aussi actifs que la molécule originale (p.ex. diazépam), inactifs jusqu’à ce qu’ils soient métabolisés en médicament actif dans l’organisme (p.ex. la levodopa), ou parfois toxiques.
Le RCP va informer sur:
• Le degré de métabolisme.
• Les métabolites
• L’activité des métabolites et leur contribution à l’effet et/ou à la toxicité.
• Les enzymes impliquées dans le métabolisme.
• Le site du métabolisme.
• Les résultats d’études d’interaction in vitro indiquant si le médicament peut induire/inhiber les enzymes métaboliques 31
Les médicaments peuvent être métabolisés par oxydation, réduction, hydrolyse, hydratation, conjugaison, condensation ou isomérisation; quel que soit le processus, l’objectif est de rendre le médicament plus facile à excréter. Les enzymes qui interviennent dans le métabolisme sont présentes dans de nombreux tissus, mais sont généralement plus concentrées dans le foie. La vitesse de métabolisme des médicaments varie selon les patients. Certains patients métabolisent un médicament si rapidement que les taux sanguins et tissulaires thérapeutiquement efficaces ne sont pas atteints; chez d’autres, le métabolisme peut être si lent que des effets toxiques surviennent avec des doses usuelles. À l’échelle individuelle, les vitesses de métabolisme des médicaments sont sous l’influence de facteurs génétiques, d’états pathologiques concomitants (en particulier les hépatopathies chroniques et l’insuffisance cardiaque avancée) et des interactions médicamenteuses (en particulier celles impl¬quant l’induction ou l’inhibition du métabolisme).
L’élimination des médicaments et de ses métabolites est principalement réalisée par la voie urinaire et la voie biliaire. Les informations pertinentes du RCP concernent:
• Les demi-vies d’élimination.
• La clairance totale.
• La variabilité inter et/ou intra-sujet de la clairance totale.
• Les voies d’excrétion de la substance inchangée et des métabolites, y compris la part relative de la fraction hépatique et rénale éliminée.
• L’implication des protéines de transport.
Elles sont d’intérêt pour la prescription car pour un médicament éliminé principalement par le rein, la clairance totale sera diminuée parallèlement à la baisse de la fonction rénale mais ne sera pas affectée par une insuffisance hépatique ni par les interactions médicamenteuses métaboliques.
La nature des mécanismes mis en jeu permet d’anticiper les conséquences d’altérations physio-pathologiques chez le patient. Ainsi, la clairance hépatique d’un médicament pourra être modifiée ou non selon le type d’atteinte hépatique (p.ex. modification du débit sanguin en cas d’hypertension portale, destruction des hépatocytes lors d’une hépatite…).
Des indices physiologiques peuvent être utilisés pour adapter la posologie s’ils sont reliés à la clairance du médicament. Ainsi, la clairance des aminosides dépend de la filtration glomérulaire et sera donc diminuée parallèlement à l’altération de la clairance de la créatinine.
La pharmacocinétique d’un médicament est dite linéaire si les paramètres pharmacocinétiques ne varient pas avec la dose. C’est le cas de la majorité des médicaments.
Dans le cadre d’une cinétique linéaire, l’évolution des concentrations du médicament est prévisible pour tout schéma posologique, à condition bien sûr qu’aucun événement intercurrent ne vienne modifier les paramètres individuels.
Les médicaments dont la pharmacocinétique n’est pas linéaire sont difficiles à manier car les modifications de posologie s’accompagnent de variations imprévisibles des concentra¬tions. La non-linéarité des cinétiques résulte le plus souvent de la saturation de l’un des processus pharmacocinétiques (ex. phénytoïne et saturation du métabolisme).
Les variations cliniquement pertinentes dans la pharmacocinétique par rapport à des facteurs tels que l’âge, le poids, le genre, le tabagisme, une insuffisance rénale ou hépatique (y compris le degré d’insuffisance) seront également mentionnées. Dans ce cas, elles sont décrites en termes quantitatifs avec renvoi à la rubrique 4.2 (Posologie et mode d’administration), le cas échéant.
Enfin, d’autres informations pourront compléter cette section, telles que la relation entre dose/concentration/paramètre pharmacodynamique et effet avec une description de la population étudiée, ainsi que les résultats des études pharmacocinétiques dans les différents groupes d’âge pédiatriques avec une comparaison avec les adultes si disponibles.
Cette section fournit des informations sur tous les résultats des essais non cliniques qui pourraient être pertinents pour le prescripteur et qui ne sont pas déjà mentionnées dans d’autres sections du RCP.
Ces données additionnelles peuvent concerner la pharmacologie de sécurité, la toxicologie, la génotoxicité, le potentiel cancérigène, la reproduction et le développement ou encore sur les données de sécurité sur des animaux juvéniles.
Après quatre mois, cette visite guidée du RCP s’achève. Le plan et contenu de chaque étape a été rédigé sur base d’une série de présentations faisant partie d’une formation offerte par l’Agence européenne des médicaments et qui sont publiquement accessibles sur son site. Tout comme les ajouts de certaines définitions qui ont été repris d’autres sites, ils sont référencés ici:
• www.ema.europa.eu/en/glossary/ summary-product-characteristics
• www.ema.europa.eu/en/human-regulatory/marketing-authorisation/ product-information/how-prepare-review-summary-product-characteristics#training-presentations-section
• www.pharmacomedicale.org
• www.msdmanuals.com/fr/professional
for articles/videos/studies
The articles can be sorted by therapeutic area or disease, but may also deal with more general topics not specifically related to a disease. These articles can be sorted as "other".