

Article paru dans le magazine SEMPER – édition Jan 2022 – www.dsb.lu
REGULATORY : Une rubrique originale de Semper Luxembourg en collaboration avec la Division de la Pharmacie et des Médicaments - Sous la Direction du Dr Anna Chioti
Comment la Division de la Pharmacie et des Médicaments s’est adaptée à la gestion de la crise COVID. Comment elle se modernise et se transforme progressivement pour donner naissance à l’Agence Luxembourgeoise des Médicaments et Produits de Santé (ALMPS).
Les questions suscitées par l’arrivée des vaccins anti-Covid ont mis en avant le rôle des agences de sécurité sanitaire et plus particulièrement des autorités compétentes en charge des médicaments et des produits de santé. Au Luxembourg, les questions relatives aux médicaments et produits pharmaceutiques en général et en particulier leur fabrication, leur contrôle, leur mise sur le marché, leur publicité, leur distribution, leur importation et leur exportation sont de la compétence de la Division de la Pharmacie et des Médicaments (DPM). Le rôle de cette dernière a évolué au fil du temps, mais nous verrons qu’il a pris une ampleur considérable depuis l’arrivée des vaccins anti-COVID.
Suite à des questions récurrentes du terrain, il s’avère que l’organisation du contrôle des médicaments et des produits de santé au Luxembourg par la DPM est une activité assez méconnue du public mais aussi des professionnels de santé.
De par sa complexité, de par le nombre conséquent de lois et règlements qui l’encadrent et de par son interaction avec les différents acteurs de la surveillance du marché et de la sécurité sanitaire, l’activité de contrôle des médicaments devient difficile à cerner et à comprendre.
C’est pourquoi, la DPM communique sur ses activités depuis septembre 2019 dans la désormais établie «Rubrique Regulatory» du Semper, mais aussi à travers des présentations thématiques lors d’événements et des séances de formations professionnelles.
Les circulaires à l’attention des professionnels de santé sont désormais également accessibles via l’application Telegram de la Direction de la santé et le site de la DPM conti¬nue à être alimenté en informations utiles.
Après une introduction historique sur le rôle des agences et de la législation luxembourgeoise, ce numéro vous propose une rétrospective sur les réalisations de la DPM avec pour objectif de mettre en lumière ses activités principales, désormais structurées en piliers d’activité spécifiques pour se rapprocher de celles d’une vraie agence ou autorité compétente, mais aussi de préciser son rôle étendu dans la gestion de la crise COVID.
.jpg)
Au cours du XIXe siècle, la qualité des produits pharmaceutiques devient une véritable préoccupation des pouvoirs publics et des «polices des remèdes» voient le jour dans un souci de lutter contre le charlatanisme et la contrefaçon.
Par la suite, les avancées dues à l’industrialisation ont nécessité la mise en place de systèmes de supervision plus sophistiqués suite à la politisation de la santé publique, aux innovations scientifiques, et suite à de graves scandales sanitaires.
Ce sont malheureusement les accidents sanitaires qui vont permettre de renforcer le contrôle de la production pharmaceutique.
En 1906, aux Etats-Unis, la commercialisation de médicaments frelatés provoque une vague d’intoxication mortelle qui conduit à l’adoption d’une première législation de contrôle des denrées alimentaires et des médicaments, ainsi qu’à la création de la Food and Drug Administration (FDA).
La réglementation se durcit en 1938, après une seconde crise sanitaire liée à l’ingestion toxique de l’élixir de sulfanilamide, médicament distribué tout juste après la reconnaissance de l’efficacité thérapeutique des sulfa¬mides contre des infections comme la pneumonie.
Avant toute commercialisation, les compagnies pharmaceutiques seront désormais tenues de mener des tests de sécurité sur les animaux et d’en soumettre les résultats à la FDA.
L’Europe sera amenée à son tour, à créer des instances similaires. En France notamment, un scandale sanitaire éclate en 1954, où une centaine de personnes meurent après avoir consommé du Stalinon, un médica¬ment à base d’étain prescrit contre la furonculose. Le procès de l’entreprise révèle un dysfonctionnement de toute la chaîne de distribution du médicament: essais cliniques insuffisants, contrôle de qualité déficient, et un simple visa ministériel qui ne suffit pas à garantir la sécurité du produit…
L’adoption d’une directive européenne en 1965 harmonise enfin les procédures nationales pour l’enregistrement des médicaments, fondées sur un dossier détaillé que le fabricant doit fournir.
Celui-ci doit garantir: la qualité pharmaceutique (composition, stabilité, reproductibilité à grande échelle...), la sécurité d’emploi (effets indésirables, précautions d’emploi...) et l’efficacité du médicament (données des essais cliniques du produit).
Après examen de ces trois critères (qualité, efficacité et sécurité), les experts évaluent le «rapport bénéfice/risque» du médicament et délivrent une Autorisation de Mise sur le Marché (AMM) pour une durée de cinq ans.
Ces dispositions jettent les bases de l’Agence européenne du médicament (EMA), créée à Londres en 1995 pour coordonner et centraliser l’enregistrement des médicaments dans la Communauté européenne.
A l’échelle internationale, l’immense crise sanitaire de la thalidomide contribue à l’adoption des normes sur le marché des médicaments encore plus strictes dans les années 1960.
La thalidomide était utilisée dans des spécialités contre la toux et la nausée vendues dans plusieurs dizaines de pays. Le succès commercial était immense, favorisé par des campagnes publicitaires de son fabricant auprès des médecins, les incitant à prescrire le médicament aux femmes enceintes. A partir de 1961, plus de 10 000 malformations chez les nouveau-nés sont signalées en Europe, Australie et Canada. Il devient alors urgent d’améliorer la communication internationale sur les effets médicamenteux indésirables.
L’OMS lance alors un programme de surveillance international avec la constitution de centres de pharmacovigilance dans 10 pays en 1963. De¬puis 1971, ils sont sous la dépendance du Centre mondial de pharmacovigilance.
Aujourd’hui basé à Uppsala en Suède, l’UMC (Uppsala Monitoring Center) a pour mission de recueillir les données des centres nationaux de pharmacovigilance des États membres de l’OMS, concernant les signaux de nouveaux effets indésirables des médicaments.
En 2020, la DPM a permis au Luxembourg de rejoindre le réseau de pharmacovigilance de l’OMS où elle est point focal pour l’UMC.
.jpg) Le contexte historique luxembourgeois
Le contexte historique luxembourgeoisA l’instar de l’évolution des législations pour l’établissement des agences de surveillance des médicaments dans les autres pays, on notera ci-dessous l’évolution propre au Luxembourg de la fonction de «police médicale» vers les missions variées de la DPM telles que nous les connaissons aujourd’hui, au travers de quelques textes pertinents:
• L’ordonnance royale grand-ducale modifiée du 12 octobre 1841 portant organisation du service médical, dans sa sixième section dé¬crit «la manière de constater les délits de police médicale et des pénalités» et on peut y lire que «les officines […] seront visitées au moins une fois par an. Le collège médical déléguera à cet effet un ou plusieurs de ses membres. Ces délégués devront être accompagnés par un agent de la police judiciaire, chargé de constater, le cas échéant, les délits».
• La Loi du 6 avril 1881 sur la falsification des denrées et boissons alimentaires: «le commerce de denrées et boissons alimentaires et médicamenteuses,…, est soumis à la surveillance de l’autorité». Cette autorité était représentée à l’époque par des «fonctionnaires et agents de la police générale ou locale».
• La Loi du 28 avril 1922 concernant la préparation et la vente des médicaments et des substances toxiques, est plutôt axée sur le volet des inspections en précisant que «les agents du Gouvernement chargés de cette inspection ont la qualité d’officiers de la police judiciaire».
• L’Arrêté grand-ducal du 12 juillet 1927 portant réglementation de la préparation, de la conservation et de la vente en gros des substances médicamenteuses et des produits pharmaceutiques en général, stipule qu’«indépendamment des officiers de police judiciaire, les inspecteurs des pharmacies et les délégués du Collège médical ont mission de veiller à l’application du présent arrêté».
• Le Règlement grand-ducal du 11 juin 1948 portant réorganisation du service de l’inspection des pharma¬cies, des dépôts de médicaments, des drogueries, des fabriques de substances toxiques et médicamen¬teuses ainsi que des locaux servant au débit ou au dépôt de ces subs¬tances, établit la fonction d’«agent portant le titre d’inspecteur des pharmacies»
| «A l’échelle internationale, l’immense crise sanitaire de la thalidomide contribue à l’adoption des normes sur le marché des médicaments encore plus strictes dans les années 1960.» |
• L’Arrêté grand-ducal du 25 sep¬tembre 1953, portant règlement d’exécution de la loi du 28 avril 1922 sur la préparation et la vente des médicaments toxiques, dans son article 16, stipule qu’«indépendam¬ment des officiers de la police ju¬diciaire, le Médecin-Directeur de la Santé publique, les médecins-ins¬pecteurs et le médecin inspec¬teur adjoint ont mission de veiller à l´application des dispositions de la loi du 28 avril 1922 et des arrêtés pris pour son exécution».
• La loi du 24 novembre 2015 modifiant la loi modifiée du 21 novembre 1980 portant organisation de la Direction de la santé, énumère les missions de la DPM.
Les missions légales les plus récentes de la DPM sont en ligne avec les fonctions réglementaires minimales pour une autorité compétente nationale ou Agence, telles que définies par l’OMS et que l’on peut regrouper comme ci-dessous:
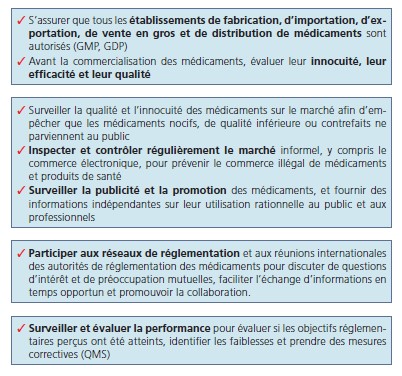
.jpg)
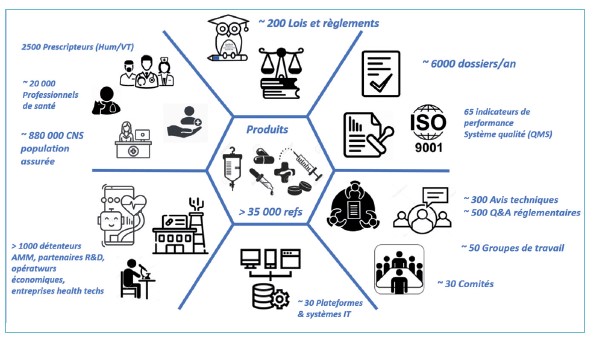
La cartographie des activités de la DPM a mis en évidence l’ordre de grandeur du portefeuille des activités de la DPM.
L’illustration chiffrée page suivante donne un aperçu de l’ensemble des milliers d’interactions potentielles que la DPM doit pouvoir gérer au quotidien.
Vu la quantité croissante de médicaments et produits de santé arrivant sur le marché, vu l’introduction de plusieurs nouveaux règlements et directives européens les cinq dernières années et vu l’évolution de l’écosystème luxembourgeois avec l’arrivée de nouveaux opérateurs économiques dans le domaine des produits de santé innovants, l’ancien mode de fonctionnement de la DPM, basé sur un même profil de compétences n’était plus adapté aux exigences d’un secteur de plus en plus mouvementé.
En effet, un renforcement des capacités et des compétences s’avère nécessaire pour face à ces évolutions et pour permettre au Luxembourg de se mettre au niveau des autres états membres de l’Union européenne.
La structuration des activités de la DPM s’est poursuivie en 2020 et 2021 avec l’objectif de développer un système de gestion de la qualité (QMS).
Cette structuration reflète la nécessité de développer des pôles de com¬pétences spécifiques en lien avec les fonctions minimales réglementaires permettant à la Direction de la santé, respectivement au Ministère de la Santé d’assurer le rôle d’autorité compétente nationale en matière de médicaments et produits de santé. Les missions décrites plus haut font partie du périmètre du QMS et ont servi de base à l’élaboration de l’organigramme de la DPM que l’on peut retrouver dans le dernier rapport d’activité du Ministère de la Santé.
Les tableaux sur les pages suivantes résument les missions et activités principales nécessaires au bon fonctionnement des piliers de l’organigramme de la DPM tels que sont notamment les AMM et la pharmacovigilance. On y retrouve également quelques chiffres clés issus du rapport d’activités 2020. L’année en cours n’étant pas encore clôturée, les chiffres actualisés seront publiés dans le prochain rapport d’activité de 2021.
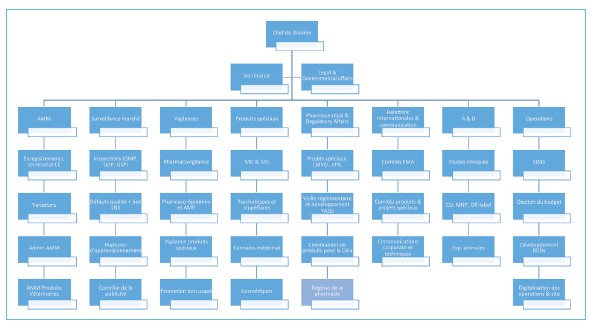



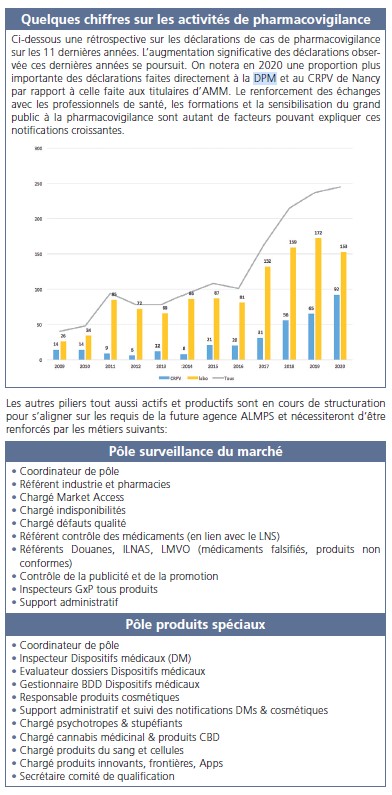
D’autres pôles sont en cours de développement tels que:
• La coordination des affaires réglementaires et pharmaceutiques, comprenant notamment les activités en lien avec les substances spécialement réglementées, le régime de la pharmacie ainsi que l’implémentation du règlement européen sur les essais cliniques.
• Le pôle des produits vétérinaires avec l’implémentation du nouveau règlement européen.
• La coordination opérationnelle et les services de support transversaux, comprenant entre autres le volet digitalisation des procédures et la gestion de la qualité, mais aussi la gestion pharmaceutique et logistique des acquisitions et de l’approvisionnement national de médicaments et produits de santé.
Compléter cet organigramme passe par l’augmentation des ressources humaines, la mise à niveau et la formation continue au niveau scientifique et réglementaire. Le recrutement de profils diversifiés et la création de fonctions de support opérationnel et administratif permettra de construire des équipes multidisciplinaires qui devront être dotées des moyens techniques pour augmenter l’efficience et la qualité du service par la structuration et la digitalisation des procédures.
Depuis 2018, outre les fonctions classiques de pharmacien avec expérience officinale, l’équipe de la DPM a été renforcée au fur et à mesure des remplacements et de la création de quelques postes par des compétences médicales au niveau humain et vété-rinaire, des compétences d’ingénieur dans le domaine de la biologie, de la documentation chimique du médicament, des affaires juridiques, réglementaires et pharmaceutiques, mais aussi des essais cliniques et du circuit de distribution du médicament.
Les pharmaciens qui constituent en¬core la majorité des postes scientifiques et techniques ont des parcours variés et apportent une expérience à la fois de terrain mais aussi des expertises acquises au sein de l’industrie pharmaceutique ou du circuit de distribution du médicament. L’équipe au sens large compte aussi des personnes avec une expertise acquise auprès d’autres agences de régulation, d’instituts de recherche et de réseaux professionnels européens. A ce titre, on peut dire que la DPM s’est considérablement transformée en une équipe de profils diversifiés et capables d’accompagner le lancement de la future agence luxembourgeoise des médicaments et des produits des santé ou ALMPS. Cette nouvelle façon de fonctionner ainsi que la pers-pective de la future ALMPS ont fait de la DPM une organisation attractive pour les talents de ce domaine très spécialisé.
L’ambition de la future agence est d’assurer un positionnement et une visibilité au niveau européen et international du Luxembourg. Outre un exercice d’évaluation comparative, dit de «benchmarking» par rapport à d’autres agences, et une analyse SWOT de l’organisation actuelle, la portée et le positionnement de la nouvelle agence ont pris en compte une analyse PESTEL présentée dans l’exposé des motifs du projet de loi 7523 portant création de l’établissement public «Agence luxembourgeoise des médicaments et produits de santé (ALMPS). Cette dernière montre toutes les opportunités pour le Luxembourg d’offrir un accès aux innovations diagnostiques et thérapeutiques à sa population, tout en occupant la sphère réglementaire européenne dans le domaine des technologies de la santé et des évaluations médico-économiques innovantes.
Le projet de loi 7523, déposé en février 2020, a vu ses travaux sérieuse¬ment impactés par la crise sanitaire car les priorités du Ministère de la Santé ont bien entendu été bouleversées. Par ailleurs, la DPM doit faire face à l’implémentation de plusieurs règlements européens dont le timing est concomitant avec le PL7523 et le PL7383 (projet visant à modifier plusieurs lois en lien avec le circuit du médicament). Ces règlements européens concernent les dispositifs médicaux, les dispositifs médicaux de diagnostic in vitro, les essais cliniques et le règlement pour les médicaments vétérinaires. A cela, se sont ajoutées les lois COVID successives qui touchent au circuit du médicament, puisque la DPM est en première ligne pour assurer l’accès aux nouveaux traitements et vaccins COVID.

Dans le cadre de la crise sanitaire liée au Covid-19, dès le mois de mars 2020, la DPM a accompagné le terrain afin de mettre à disposition des patients COVID-19 en fin de vie les médicaments nécessaires, ci-inclus la mise en place de soins palliatifs pour les résidents des maisons de retraite souffrant de COVID-19 via les autorisations d’importation des produits nécessaires.
De plus, la DPM a travaillé avec la Division de la médecine sociale afin de mettre en oeuvre une offre de traite¬ment de toxicomanie par substitution bas-seuil au sein d’Abrigado CNDS, pour répondre aux besoins d’une po¬pulation toxicomane vulnérable pendant la crise COVID, y compris un accompagnement réglementaire pour la conformité des prestataires.
Les importations liées au COVID-19 ont augmenté considérablement. La cellule des dispositifs médicaux de la DPM a été fortement sollicitée par l’Administration des Douanes et Accises (ADA) pour des contrôles de conformité de dispositifs médicaux, notamment des masques chirurgi¬caux, des gants d’examen et des tests diagnostiques SARS CoV-2.
Par ailleurs, tous les collaborateurs ont été sollicités pour des tâches qui sortent du cadre des missions de la DPM pour soutenir l’effort commun de lutte contre la pandémie.
Au niveau européen, les activités des différents comités de l’EMA, dont celles du Comité des médicaments humains (CHMP) ont été fortement impactées par la pandémie. En effet, tous les médicaments développés afin de traiter ou d’immuniser contre le Co-vid-19 sont évalués par l’EMA. Pour la première fois, le CHMP a eu recours à la «rolling review», une procédure d’évaluation au fur et à mesure de la mise à disposition des données par lesfirmes, permettant de donner des avis plus rapides sur l’utilisation des vaccins COVID. Les membres ont ainsi dû se réunir, en plus des réunions mensuelles standard, avec une fréquence permettant de discuter des nouvelles données soumisses par les firmes.
A titre informatif, rien qu’en décembre 2020, le CHMP s’est réuni par téléconférences pendant un total de 75 heures. La préparation des réunions, le traitement administratif des documents ainsi que le suivi des actions ne sont pas inclus dans ce total.
De plus, plusieurs avis de la DPM re¬commandant des dérogations aux étiquetages et notices des vaccins ont été transférés au service juridique du Ministère de la Santé, afin de faciliter le lancement de la vaccination.
Plusieurs personnes de la DPM ont participé aux réunions planifiées et extraordinaires mises en place par l’Agence européenne des médicaments (EMA) au sein des comités sui¬vants: ETF (Emergency Task Force), CHMP (Comité des médicaments hu¬mains), PRAC (comité pharmacovigilance), EMRN (réseau réglementaire pour les chefs d’agence), EU SPOC shortages related to major events (suivi des tensions d’approvisionnements en médicaments liées à la crise COVID).
En vous rendant sur le site internet de la Direction de la santé (https://sante.public.lu/fr/politique-sante/ministere-sante/direction-sante/div-pharmacie-medicaments/index.html), vous trouverez toutes les adresses emails génériques pour les différentes questions dont la DPM est en charge ainsi que des informations utiles sur la pharmacovigilance.
Vous trouverez également la liste des Communications directes pour les professionnels de santé (ou DHPC – direct healthcare professional communication) qui ont pour but de fournir de nouvelles informations importantes relatives à la sécurité d’un médicament ainsi que des mesures à prendre pour limiter les risques éventuels lors de son utilisation. Les DHPC constituent un élément important dans la promotion du bon usage des médicaments. Elles sont transmises par les laboratoires pharmaceutiques après l’approbation préalable et sous l’autorité de la Direction de la santé (DPM) et/ou de l’EMA.
D’autres informations utiles pour les titulaires d’AMM et les firmes concernées par les dispositifs médicaux com¬plètent la page du site dédiée à la DPM.
Références:
1. Numéros de Semper Luxembourg, Rubrique Regulatory (septembre 2019 à décembre 2021)
2. Qui contrôle les médicaments ? Une histoire des agences sanitaires, par Pauline Petit (https://www.franceculture.fr/histoire/qui-controle-les-medicaments-une-histoire-des-agences-sanitaires)
3. Chauveau, Sophie. «Genèse de la «sécurité sanitaire»: les produits pharmaceutiques en France aux XIXe et XXe siècles», Revue d’histoire moderne & contempo¬raine, vol. no51-2, no. 2, 2004, pp. 88-117
4. Journal officiel du Grand-Duché de Luxembourg (https://legilux.public.lu/)
5. Diaporamas présentés par Dr Anna Chioti lors des réunions avec APL Pharma
6. Projet de loi 7523 - Projet de loi portant création de l’établissement public «Agence luxembourgeoise des médicaments et produits de santé (ALMPS), exposé des motifs (www.chd.lu)
7. Rapport d’activité du ministère de la Santé 2020 (https://sante.public.lu/ fr/publications/r/rapport-activite-ministere-sante-2020/index.html)
8. Site de la DPM (https://sante.public.lu/ fr/politique-sante/ministere-sante/direction-sante/div-pharmacie-medicaments/ index.html)

for articles/videos/studies
The articles can be sorted by therapeutic area or disease, but may also deal with more general topics not specifically related to a disease. These articles can be sorted as "other".