

Les essais de phase I constituent une des étapes indispensables pour le développement des nouveaux médicaments.
Leur objectif principal n’est pas de rechercher un effet thérapeutique, mais d’évaluer la toxicité en déterminant la dose maximale tolérée d’une nouvelle molécule susceptible de devenir un futur médicament. A ce stade de développement, il s’agit d’évaluer la tolérance de l’organisme au produit en question et dans le même temps de déterminer la dose recommandée lors de la poursuite des essais cliniques (phases II et III).
Les premiers essais sur l’homme d’un nouveau produit pharmaceutique, qui comportent habituellement dans leurs protocoles une augmentation des doses par paliers, ne sont pas dénués de risques. Un volontaire sain peut en effet développer une violente réaction, inattendue, soudaine et grave, suite à l’administration d’une nouvelle molécule. Entre autres possibilités, un volontaire sain peut développer une sévère réaction d’origine immunologique à un produit.
C’est d’ailleurs cette dernière hypothèse qui a été évoquée par le professeur Pierre-Gilles Edan, chef du service neurosciences du CHU de Rennes. Les cinq autres victimes de l’essai qui ont été hospitalisées au CHU de Rennes, tous des hommes, ont d’ailleurs été traitées avec 1 gramme de corticoïde par jour pendant dix jours, sans que l’on sache si c’est ce qui les a sauvées.
L’Inspection générale des affaires sociales (IGAS) en France a pointé un manquement majeur de la part de la société représentant le promoteur à la réglementation en vigueur qui impose qu’un tel accident, devant être qualifié de fait nouveau, doit être immédiatement déclaré aux autorités administratives (ANSM: Agence Nationale de Sécurité du Médicament et des
Produits de Santé et CPP: Comité de protection des personnes). Un tel retard étant de nature à compromettre la sécurité de l’ensemble des personnes participant au même essai ou à des essais similaires, la ministre des Affaires sociales et de la Santé a émis, le 1er mars, une circulaire à l’attention des directeurs généraux des Agences régionales de santé, relative aux déclarations des faits nouveaux et des évènements indésirables graves survenant au cours des essais cliniques1. En effet, lors des essais cliniques la réglementation européenne est très claire et exige que les événements ou effets indésirables graves soient rapportés immédiatement aux autorités compétentes. Cette notification ne doit en aucun cas dépasser 24 heures après la connaissance de l’événement indésirable grave2.
Tout événement ou effet indésirable qui, quelle que soit la dose administrée, entraîne le décès, met en danger la vie du participant, engendre une hospitalisation ou la prolongation de l’hospitalisation, provoque un handicap ou une incapacité importants ou durables, génère une anomalie ou une malformation congénitale ou tout événement médical jugé important
par l’investigateur et qui pourrait mettre en danger le patient3.
Avant l’essai clinique de Rennes, il y a eu un autre essai qui hante encore toutes les mémoires dans le milieu médical. Il s’agissait d’une étude britannique de phase I où, en 2006, six jeunes hommes avaient frôlé la mort suite à l’administration de la molécule TGN1412. Malgré divers traitements, ces volontaires sains ont été admis en soins intensifs, victimes d’une défaillance multi-viscérale provoquée par un «orage cytokinique», c’est-à-dire la libération systémique de cytokines
pro-inflammatoires menaçant le pronostic vital, ou syndrome de relargage des cytokines (CRS: cytokine-release
syndrome)4. Les six volontaires ont pu s’en sortir grâce à l’instauration rapide d’un traitement empirique visant à
contrecarrer l’action de l’IL-2 combiné aux soins de support classiques. L’essai de phase I français mené à Rennes concernait le BIA10-2474, un produit destiné à traiter les troubles de l’humeur et de l’anxiété, voire des troubles moteurs comme ceux associés à la maladie de Parkinson. Le BIA10-2474 fait partie d’une nouvelle famille chimique qui a rapidement
enthousiasmé les chercheurs, celle des inhibiteurs de la FAAH (fatty acid amide hydrolase), enzyme qui intervient dans la régulation de la libération de neurotransmetteurs, et qui est doté d’une activité antalgique via son action les récepteurs cannabinoïdes (CB1 et CB2) du système endocannabinoïde. Le récepteur CB1 est exprimé dans le système nerveux central et périphérique, tandis que le CB2 est exprimé essentiellement dans les cellules du système immunitaire. Entre 2009 et 2014, de nombreux laboratoires tels que Sanofi, Pfizer, Merck, Johnson & Johnson, Amgen, Abbott, etc., ont déposé des brevets pour protéger «leur» inhibiteur de FAAH, une famille de médicaments à qui l’on prêtait à leur naissance des vertus quasi miraculeuses. Pour l’instant, les résultats obtenus avec les divers inhibiteurs de FAAH pèchent plutôt par leur manque d’efficacité…
Un volontaire sain peut développer une violente réaction, inattendue, soudaine et grave, suite à l’administration d’une nouvelle molécule. |
Une méta-analyse sur les données de plusieurs études de phase I menées entre septembre 2004 et mars 2011 dans les 3 unités de phase I de Pfizer en Belgique, Singapour et aux Etats- Unis a été publiée dans le BMJ5. Parmi les 11 028 volontaires sains qui ont reçu un médicament à l’étude en phase I, 34 (soit 0,31%) ont présenté un événement indésirable grave, mais il n’y a eu aucun décès ou événement menaçant la vie des participants. La moitié des événements indésirables
graves ont été sans rapport avec le médicament d’étude ou une procédure de recherche. 84% de tous les événements indésirables ont été légers et 1% étaient graves. Les événements indésirables les plus fréquents ont été des céphalées, de
la fatigue ou de la somnolence, de la diarrhée, des nausées et des vertiges ou des étourdissements. Parmi les 34 effets indésirables graves, la moitié était liée à l’étude, dont 11 provoqués par le médicament à l’étude elle-même et sept causés par des interventions chirurgicales ou médicales liées à l’essai, tels que des ponctions lombaires. D’autres effets indésirables graves non liés au médicament comprenaient la dengue hémorragique et l’appendicite. Certains facteurs ont été associés à un risque accru d’effets indésirables: par exemple, les femmes étaient beaucoup plus susceptibles que les hommes de
faire l’expérience d’un événement indésirable (80% contre 62%). Les chercheurs ont constaté que les participants ayant des antécédents de consommation d’alcool étaient plus susceptibles d’éprouver un événement indésirable que ceux sans (69% contre 60%), par contre aucune susceptibilité accrue n’a été observée pour les personnes ayant des antécédents de tabagisme (64% dans les deux groupes). La publication récente d’une revue systématique de la littérature (janvier 2008 à octobre 2012) dans la revue Clinical Trials6 a repris les données de 475 études de phase I, représentant un total de 27 185 participants. Dans 98% des essais inclus dans cette revue, aucun événement ou effet indésirable grave lié au médicament n’a été observé. Il y a eu cinq décès au total, mais aucun n’a été lié au produit administré dans l’étude. Des “désagréments” légers étaient répandus dans l’ensemble des essais, alors que des événements plus graves ont été confinés à un petit
sous-groupe d’essais. Dans ce petit sous-groupe, les taux d’événements indésirables observés ne montrent pas que les risques d’essais de phase I soient extrêmement élevés, avec une médiane de 1,66 EI graves/1 000 participants/ jour de surveillance EI (EI: événement indésirable). Malgré les nombreuses limitations de ces études, on peut conclure dans
l’ensemble que le risque général est relativement faible. Une nuance est toutefois à apporter pour certaines petites molécules, notamment celles qui agissent, comme les anticorps monoclonaux, sur le système immunitaire. Si on reprend les chiffres des études sur de tels anticorps (entre 5 000 et 10 000 volontaires sains) et que l’on considère les 6 volontaires qui ont donc présenté un sérieux effet secondaire avec le TGN1412, on se retrouve avec un risque d’accident menaçant la vie compris entre 1/850 et 1/1 700. Un risque qui devient finalement «complètement inacceptable», d’après les auteurs de
l’article paru en 2013 dans le British Journal of Clinical Pharmacology7, dans la mesure, rapportaient-ils, qu’il dépasse largement les risques associés aux activités sportives considérées comme les plus dangereuses (parachutisme).
En fait, il serait du même ordre que le saut extrême ou base jumping, qui consiste à sauter en parachute depuis des objets fixes et non d’un avion (un mort pour 2 317 sauts)8.
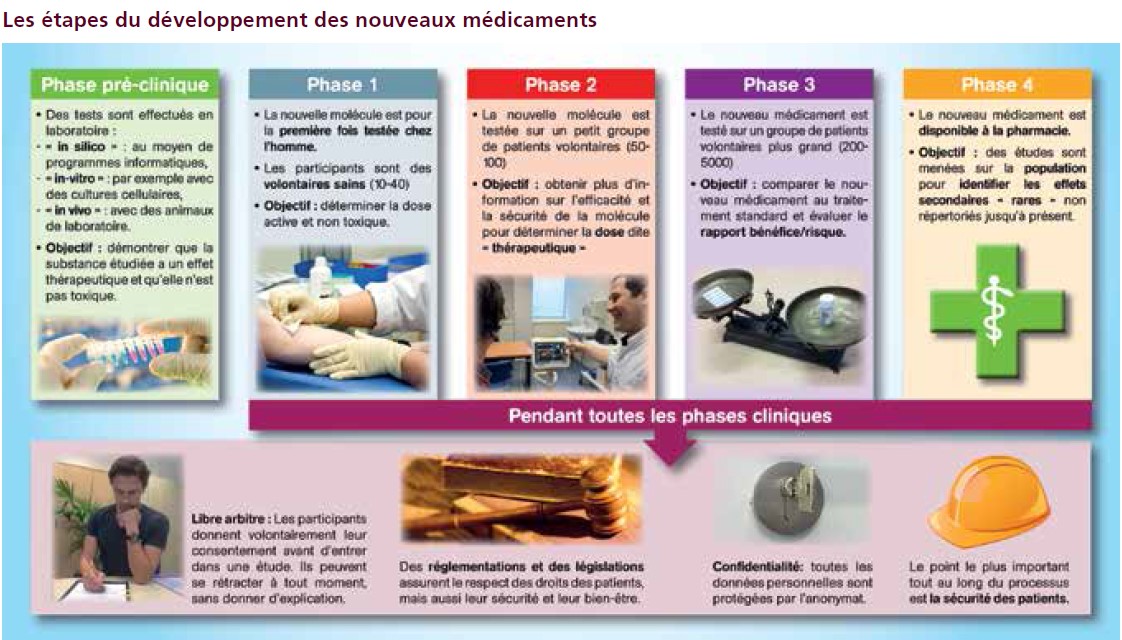
L’agence européenne du médicament, l’EMA9 et la FDA (Food and Drug Administration) 10 aux Etats-Unis ont émis des recommandations à l’attention des promoteurs des études de première administration chez l’homme. Les recommandations européennes visent à aider les promoteurs à faire la transition de la phase préclinique vers la phase de développement clinique précoce dans de meilleures conditions de sécurité pour les participants humains. Elles identifient les facteurs de risque liés aux nouveaux médicaments expérimentaux et considèrent les aspects liés à la qualité, les stratégies d’essais précliniques et cliniques et les concepts d’étude de première administration à l’homme. Elles renseignent les stratégies de minimisation et de gestion des risques, y compris le calcul de la dose initiale qui doit être utilisée chez l’homme, l’augmentation de la dose suivante, et la conduite de l’essai clinique dans son ensemble. Les recommandations américaines
concernent surtout l’évaluation de la sécurité préclinique: la caractérisation des effets toxiques par rapport aux organes
cibles, la dose, la relation à l’exposition, et, le cas échéant, la réversibilité potentielle. Cette information sera utilisée pour estimer une dose initiale suffisamment sûre pour les essais humains et pour identifier les paramètres pour la surveillance clinique des effets indésirables potentiels.
Les études de phase I telles que celles qui se font à Rennes, par exemple, n’ont pas lieu au Luxembourg car il n’existe pas de structure habilitée à faire ce type d’études. Typiquement, les unités de phase I font l’objet d’une réglementation, comme la loi Huriet en France sur la recherche biomédicale qui exige entre autres une supervision et une accréditation des unités de phase I par les autorités compétentes (ANSM, agences régionales). En ce qui concerne l’accréditation, il existe des guidances comme celle de l’ABPI (Association of the British Pharmaceutical Industry) au Royaume-Uni11. En Belgique, les unités de phase I font l’objet d’une supervision par l’AFMPS (Agence Fédérale des Médicaments et des Produits de Santé)
et sont regroupées en une association professionnelle, la BAPU (Belgian Association of Phase 1 Units)12.
Le cadre légal et réglementaire n’étant pas encore en place au Luxembourg, seules quelques études de phase I dans
le domaine de l’oncologie ont eu lieu au Centre Hospitalier de Luxembourg. Ces études visaient principalement à étudier
la pharmacocinétique chez des patients cancéreux de médicaments déjà administrés auparavant chez l’homme et dont le profil de tolérance était déjà bien connu.
L’évolution du paysage de la recherche biomédicale au Luxembourg et la nécessité de valoriser notre recherche fondamentale, notamment en oncologie, nécessitera à terme le développement de la recherche dite translationnelle et des activités de phase clinique précoces, ou exploratoires. |
L’objectif de ces essais était d’étudier l’ADME (administration, distribution, métabolisation et excrétion du principe actif et de ses métabolites) chez les patients atteints de tumeurs malignes pouvant influencer ces paramètres et avoir un impact sur l’efficacité clinique du médicament étudié. Mais les adaptations réglementaires peuvent être longues et compliquées
car la sécurité des participants à ces études est primordiale et le niveau de risque pourrait freiner les ambitions de certains. L’évolution du paysage de la recherche biomédicale au Luxembourg et la nécessité de valoriser notre recherche fondamentale, notamment en oncologie, nécessitera à terme le développement de la recherche dite translationnelle et des
activités de phase clinique précoces, ou exploratoires. Tout en assurant la sécurité des participants, les exigences des essais exploratoires sont moins contraignantes car l’exposition des sujets est limitée et l’objectif n’est pas d’atteindre des doses qui peuvent provoquer une toxicité.
Les études exploratoires que nous pourrions envisager au Luxembourg
pourraient n’avoir aucune intention thérapeutique ou diagnostique dans un premier temps. Les études exploratoires
pourront entre autres avoir les objectifs suivants:
• confirmer la présence d’une voie biologique/mécanisme chez l’homme,
• établir si un nouveau médicament possède un profil pharmacocinétique acceptable à des doses pharmacologiques,
• établir la validité des modèles de maladies précliniques pour les maladies humaines,
• caractériser les biomarqueurs de la maladie humaine et une réponse pharmacodynamique à un nouveau médicament chez les patients peu malades,
• valider les modèles cliniques chez des volontaires sains,
• examiner le potentiel d’interactions médicamenteuses,
• évaluer l’affinité de liaison ou de métabolites produits chez l’homme,
• découvrir une nouvelle cible thérapeutique potentielle par rapport aux autres thérapies établies.
Ce modèle nécessitera la collaboration des acteurs de terrain (chercheurs, médecins, pharmaciens, hôpitaux, biobanque,
etc.) et la mise en place d’un cadre réglementaire ou au moins de guidances, telles que celles développées chez nos voisins, par les autorités compétentes concernées: CNER (Comité National d’Ethique de la Recherche), CNPD (Commission Nationale pour la Protection des Données), DPM (Division de la Pharmacie et des Médicaments, Direction de la Santé). L’AFMPS13 en Belgique a émis une guidance pour la bonne conduite des essais cliniques exploratoires (aussi appelées, études de phase 0) qui sont soumises pour autorisation comme les études de phase I.
Des activités de formation des professionnels de santé impliqués dans ces recherches cliniques exploratoires ou précoces devront accompagner le
développement de cette activité au Luxembourg. Des formations sont disponibles en Belgique (BAPU), en France via le Club Phase I14, en Allemagne via l’Association for Applied Human Pharmacology (AGAH)15 et la VeKliPha (Verbund Klinische Pharmakologie in Deutschland e.V)16. Enfin, le Centre d’Investigation et d’Epidémiologie Clinique (CIEC) du Luxembourg
Institute of Health (LIH)17 est une structure dédiée à la recherche clinique et un centre de référence établi pour la conduite des essais cliniques au Luxembourg. Sa mission est de protéger la sécurité des participants soumis aux études cliniques et aux projets de recherche, en conformité avec les exigences internationales et les recommandations du CNER, de la CNPD et de la DPM. Le CIEC, structure composée de professionnels de la recherche clinique et pilotée par des experts internationaux, accompagne les cliniciens investigateurs dans leurs responsabilités, organise des formations continues
en recherche clinique et donne de la guidance scientifique, technique et réglementaire aux acteurs de la santé susceptibles d’être impliqués dans des projets de recherche impliquant des participants humains.
1 http://circulaire.legifrance.gouv.fr/pdf/2016/03/cir_40619.pdf
2 http://ec.europa.eu/health/files/eudralex/vol-10/2011_c172_01/2011_c172_01_fr.pdf
3 Pour plus de détails, consulter le numéro Semper de novembre 2014, dossier spécial “Pharmacovigilance: l’affaire de tous”, le compte-rendu de la 6ème Journée de la Recherche Clinique, organisée par le CIEC.
4 Suntharalingam, G. et al. Cytokine storm in a phase 1 trial of the anti‑CD28 monoclonal antibody TGN1412. N. Engl. J. Med. 355, 1018–1028 (2006).
5 Ezekiel JE et al. Quantifying the risks of non-oncology phase I research in healthy volunteers: metaanalysis of phase I studies. BMJ 2015;350:h3271.
6 Johnson RA et al. Risks of phase I research with healthy participants: A systematic review. Clinical Trials 2016, Vol. 13(2) 149–160.
7 Tranter E. et al. Giving monoclonal antibodies to healthy volunteers in phase 1 trials: is it safe? Br J Clin Pharmacol. 2013 Aug; 76(2): 164–172.
8 Sciencesetavenir, janvier 2016.
9 http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002988.pdf
10 http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm073246.pdf
11 http://www.abpi.org.uk/our-work/library/guidelines/Documents/guidelines_phase1_clinical_trials.pdf
12 www.bapu.be
13 http://www.fagg-afmps.be/fr/binaries/Guideline%20for%20exploratory%20clinical%20trials%20in%20Belgium%20v2%202012_tcm291-27447.pdf
14 http://www.clubphase1.com/6-0-FORMATION.html
15 http://www.agah.eu/en/about-us/ueber-dieagah/who-is-the-agah.html
16 http://www.vklipha.de/
17 https://www.lih.lu/page/departments/ciec-clinical-and-epidemiological-investigation-center-797
for articles/videos/studies
The articles can be sorted by therapeutic area or disease, but may also deal with more general topics not specifically related to a disease. These articles can be sorted as "other".